Усі тіла навколишньої живої й неживої природи складаються з дрібних
частинок — атомів: Першими, хто висловив припущення про це, вважаються
давньогрецькі філософи Левкіпп і Демокріт. Саме вони назвали атомом дрібну
неподільну частинку, що утворює речовину.
Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Ні природу, ні механізм утворення цих зв'язків вони не уточнювали, зате зробили припущення про форму атомів. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»).
Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Ні природу, ні механізм утворення цих зв'язків вони не уточнювали, зате зробили припущення про форму атомів. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»).
Більше двадцяти століть знадобилося вченим для того, щоб експериментально
підтвердити атомістичну теорію будови речовини. Остаточно ця ідея утвердилася в
науці в другій половині дев'ятнадцятого століття. До початку двадцятого
століття фізики вже мали досить інформації про масу й розміри атома. На той час
стало зрозумілим, що атоми не є дрібними частинками в складі речовини. Вони
мають певну внутрішню структуру, розгадка якої дозволила б пояснити
періодичність властивостей хімічних елементів. Однак тільки експерименти
англійського фізика Ернеста Резерфорда стали основою для створення сучасної
протонно-нейтронної моделі атома.
Механічні моделі будови атома
Вивчення атомного ядра невіддільне від вивчення елементарних частинок.
Справа в тому, що в ядрах атомів частинок настільки мало, що властивості кожної
з них не усереднюються, а відіграють важливу роль у формуванні властивостей
ядра. Тому після відкриття електрона в науці виникла безліч теорій про будову
атома.
Японський фізик Хантаро Нагаока представив будову атома аналогічною до
будови Сонячної системи: у центрі атома розташовується його позитивно заряджена
частинка (вона порівнювалася із Сонцем), навколо якої по встановлених
кільцеподібних орбітах, ніби планети, рухаються електрони. Зміщення електронів
зі своїх орбіт призводить до збудження електромагнітних хвиль.
Цей погляд на будову атома зберігався до початку двадцятого століття. Але
таку модель було важко поєднати з електродинамічними уявленнями, і вона була
відкинута, поступившись місцем моделі Томсона.
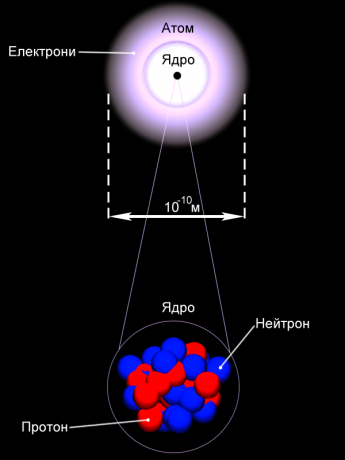
Англійський фізик Джозеф Джон Томсон запропонував модель атома у вигляді
позитивно зарядженої по всьому об'єму сфери діаметром 10~10 м, усередину якої,
ніби родзинки в пудинг, вкраплені електрони. Позитивний заряд сфери
компенсується сумарним негативним зарядом електронів. Випромінювання світла
відбувається в результаті коливання атомів відносно центру сфери.

Томсон розташував електрон в атомі Гідрогену в центрі позитивно зарядженої
сфери. У багатоелектронних атомах електрони формували в стійкі конфігурації,
параметри яких можна було розрахувати. Томсон вважав, що саме конфігурація
електронів визначає хімічні властивості атомів. Пізніше ідея Томсона розділити
електрони в атомі на групи призвела до появи теорії атомних орбіталей. Однак
пізніші відкриття змусили відмовитися від теорії Томсона на користь планетарної
моделі атома.
Однак модель атома Томсона виявилась повністю відмінною від моделі, яку
запропонував Резерфорд у результаті своїх досліджень. Резерфорд 1906 року
запропонував модель, згідно з якою будова атома дуже схожа на будову сонячної
системи. Щоб перевірити правильність своєї теорії, він провів низку дослідів,
які називають дослідами Резерфорда
Немає коментарів:
Дописати коментар